导读
研究背景:木香(AR)是一种常见的治疗胃溃疡(GU)的草药,但其抗溃疡作用的分子机制尚不清楚。目的:本研究旨在通过网络药理学和动物实验相结合,揭示AR治疗GU的潜在活性成分、核心靶点和作用机制。方法:首先,使用网络药理学方法来预测主要成分、候选靶点和潜在的信号通路。然后使用分子对接来确认主要成分和主要靶点之间的结合亲和力。最后,用30mg/kg吲哚美辛处理大鼠,建立GU模型。通过对大鼠预防性灌胃给药木香提取物(ARE)(0.15、0.3和0.6 g/kg)14天,并通过形态学观察、病理染色和生化指标检测,验证网络药理学的保护作用和候选靶点。结果:从AR中筛选出8种潜在活性成分和331个预测靶点,其中37个是与GU的交集靶点。根据成分-靶点网络和蛋白质-蛋白质相互作用(PPI)网络,确定stigmasterol、mairin、sitosterol和dehydrocostus lactone为关键组分,并选择RACα丝氨酸/苏氨酸蛋白激酶(AKT1)、前列腺素内过氧化物合酶2(PTGS2)、白细胞介素1β(IL1B)、半胱氨酸蛋白酶3(CASP3)和CASP8为核心靶点。基因本体论(GO)和京都基因与基因组百科全书(KEGG)的富集结果揭示了AR抗GU的药理机制与许多生物学过程和途径有关,包括抗菌、抗炎、前列腺素受体反应和细胞凋亡。分子对接验证表明,关键成分和核心靶点具有良好的结合亲和力。在体内实验中,AR通过降低肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β和髓过氧化物酶(MPO)的水平,显著缓解GU,同时改善胃组织病理学特征。结论:总体研究结果表明,AR治疗GU具有多组分、多靶点、多机制的治疗作用。
论文ID
原名:Pharmacological Mechanism of Aucklandiae Radix against Gastric Ulcer Based on Network Pharmacology and In Vivo Experiment
译名:基于网络药理学和体内实验的木香抗胃溃疡的药理机制
期刊:Medicina
IF:2.948
发表时间:2023.3.27
通讯作者:陈永胜、付明海
通讯作者单位:内蒙古民族大学、海南医学院
实验设计
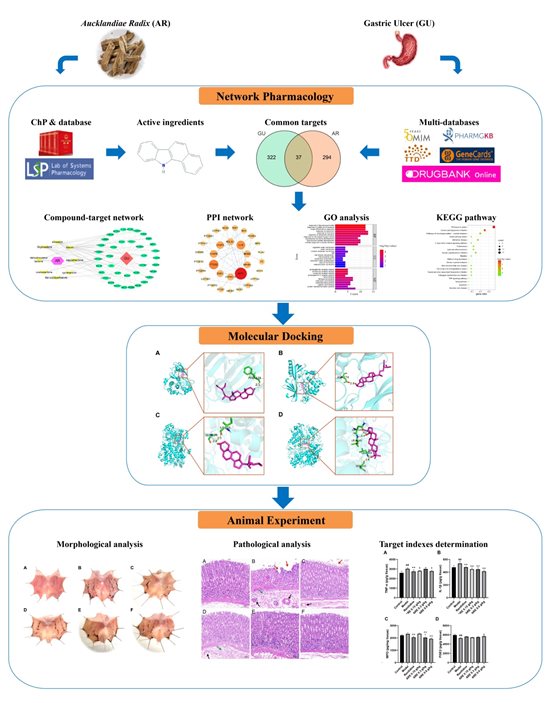
实验结果
1. AR潜在生物活性成分和靶点的预测
在TCMSP数据库中,获得了符合OB≥30%和DL≥0.18条件的AR的六个成分。ChP规定的AR成分Costunolide(OB=60.48,DL=0.11)和dehydrocostus lactone(OB=58.57,DL=0.14)也一并纳入。总共获得了8种潜在的活性成分进行后续分析,如表2所示。然后在TCMSP、BATMAN-TCM和SwissTargetPredition数据库中搜索这些潜在活性成分的相应靶点,分别找到49个、125个和197个靶点。在删除重复项后,获得了331个AR的靶点。
表2 AR的潜在活性成分
Mol ID | Molecule Name | OB (%) | DL | PubChem ID | 2D Structure |
MOL010813 | Benzo[a]carbazole | 35.22 | 0.22 | 9196 | |
MOL010828 | cynaropicrin | 67.5 | 0.38 | 119093 | |
MOL010839 | lappadilactone | 38.56 | 0.73 | 103581781 | |
MOL000211 | Mairin | 55.38 | 0.78 | 64971 | |
MOL000359 | sitosterol | 36.91 | 0.75 | 222284 | |
MOL000449 | Stigmasterol | 43.83 | 0.76 | 5280794 | |
MOL001298 | dehydrocostus lactone | 58.57 | 0.14 | 73174 | |
MOL010826 | costuslactone | 60.48 | 0.11 | 162416062 | |
2. AR治疗GU的靶点
分别从GeneCards、OMIM、PharmGKB、TTD和Drugbank获得了311个、97个、19个、9个和79个与GU相关的疾病靶点。在合并这些靶点并去除重复项后,总共获得了359个GU靶点。然后,将331个AR的靶点和359个GU靶点进行交集,得到37个交集目标,这些靶点即是AR抗GU的潜在靶点(图2)。
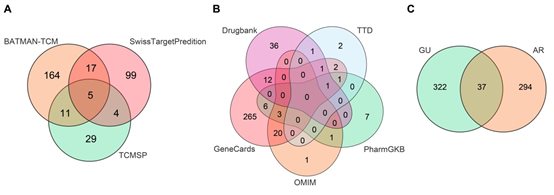
图2 AR治疗GU的靶点筛选
(A)AR潜在靶点的维恩图。(B)疾病靶点的韦恩图。(C) AR治疗GU的潜在靶点的维恩图。
3. AR抗GU的活性成分-靶点网络
构建了一个成分-靶点网络,以阐明AR的活性成分如何治疗GU。成分-靶标网中有47个节点和114个边,结果如图3所示。根据拓扑分析,stigmasterol(degree=19)、mairin(degree=16)、sitosterol(degree=15)和dehydrocostus lactone(degree=12)被预测为治疗GU的关键成分。
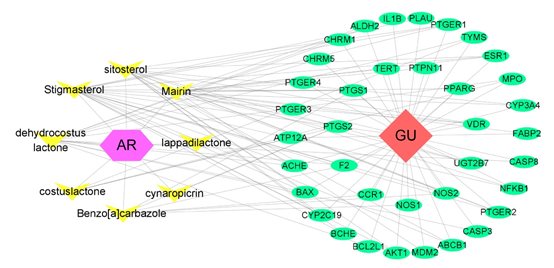
图3 成分-疾病-靶点网络
紫色六边形表示AR。黄色三角形表示AR中含有的活性成分。红色菱形表示GU。绿色椭圆表示靶点。
4. PPI网络构建和核心靶点
将AR和GU的交集靶点上传到STRING数据库,并通过Cytoscape 3.8.0软件对PPI网络进行可视化。网络中有31个节点和66条边。根据degree值筛选前10个关键靶点:AKT1、PTGS2、IL1B、CASP3、CASP8、CYP2C19、NFKB1、MDM2、BCL2L1和ESR1,预测这些靶点为AR治疗GU的核心靶点(表3和图4)。
表3 前10个潜在核心靶点
No. | Uniprot ID | Gene Name | Protein Name | Degree |
1 | P31749 | AKT1 | RAC-alpha serine/threonine-protein kinase | 14 |
2 | P35354 | PTGS2 | Prostaglandin G/H synthase 2 | 10 |
3 | P01584 | IL1B | Interleukin-1 beta | 9 |
4 | P42574 | CASP3 | Caspase-3 | 7 |
5 | Q14790 | CASP8 | Caspase-8 | 7 |
6 | P33261 | CYP2C19 | Cytochrome P450 2C19 | 6 |
7 | P19838 | NFKB1 | Nuclear factor NF-kappa-B p105 subunit | 6 |
8 | Q00987 | MDM2 | E3 ubiquitin-protein ligase Mdm2 | 6 |
9 | Q07817 | BCL2L1 | Bcl-2-like protein 1 | 6 |
10 | P03372 | ESR1 | Estrogen receptor | 6 |
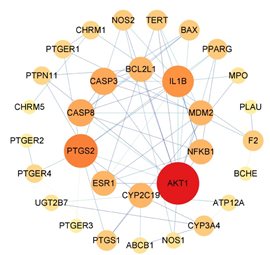
图4 AR和GU交集靶点的PPI分析
节点大小和颜色与网络中靶点的degree值成正比。
5. GO和KEGG通路富集分析
将AR和GU的交集靶点上传到Metascape平台,分析GO和KEGG通路,共获得491个GO条目和102个KEGG通路。根据p值排序,分别绘制了条形图(图5)和气泡图(图6)。GO富集分析表明,这些交集靶点与,如对脂多糖的反应、炎症反应、对细菌的反应和对激素的反应生物活性有关;细胞器外膜、外膜、核膜等细胞成分;以及分子功能,如前列腺素受体活性、血红素结合和有机酸结合。这些条目与胃黏膜损伤和修复密切相关。KEGG富集结果显示,交集靶点在包括癌症途径、人巨细胞病毒感染、神经变性途径、C型凝集素受体信号途径、癌症转录时间调控异常、TNF信号途径、凋亡等途径中显著富集。这些途径与胃粘膜损伤、溃疡愈合、以及溃疡发展为癌症。上述结果表明,AR的主要活性成分的靶点分布在不同的信号通路中。
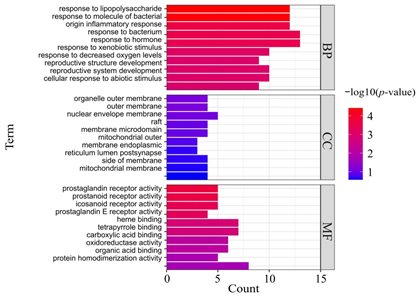
图5 生物过程(BP)、细胞成分(CC)和分子功能(MF)前10个显著富集的GO条目
y轴表示GO条目。x轴表示基因数量,颜色表示p值。
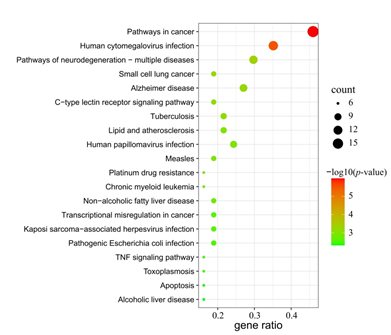
图6 AR抗GU候选靶点的前20个显著富集的通路
y轴代表KEGG途径。x轴表示在该途径中富集的基因比例。气泡的大小表示靶点的数量,颜色表示p值。
6. 分子对接验证
此外,还进行了分子对接,以阐明从PPI分析中获得的关键靶点与从网络分析中得到的主要活性成分之间的相互作用。对接结果表明,这些主要成分与关键靶点的活性位点残基结合良好。表4显示了每个对接模块的最小结合能。如图7所示,stigmasterol和AKT1之间形成了一个氢键(图7A),sitosterol和AKT1之间形成了另一个氢键。此外,stigmasterol与PTGS2中的Ile124和Ser126形成两个氢键(图7C);mairin与PTGS2的A链中的Leu145和Ser143形成两个氢键,并与PTGS2中的B链中的Asn144和Leu145形成两个双键(图7D)。上述结果表明,这些成分可以与靶点的活性位点结合。
表4 核心成分与关键靶点之间的结合能
Key Targets (PDB ID) | Stigmasterol | Mairin | Sitosterol | Dehydrocostus Lactone |
AKT1 (7NH5) | −10.4 | - | −9.9 | - |
PTGS2 (5F19) | −9.3 | −9.4 | - | - |
IL1B (5R8Q) | - | - | - | −6.9 |
CASP3 (2DKO) | - | - | - | −6.4 |
CASP8 (4JJ7) | - | - | - | −7.7 |
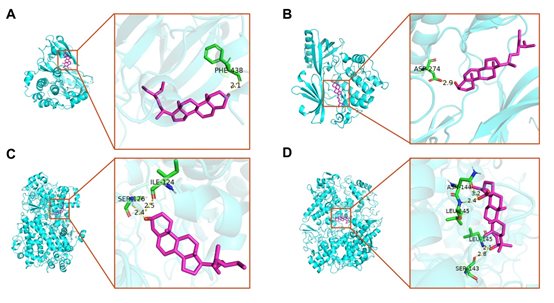
图7 AR核心靶点抗GU作用的3D图
(A)AKT1与stigmasterol的对接结果。(B)AKT1与sitosterol的对接结果。(C)PTGS2与stigmasterol的对接结果。(D)PTGS2与mairin的对接结果。紫色表示配体,绿色表示靶点的活性位点残基,氢键由黄色虚线表示。
7. AR提取物对吲哚美辛诱导的GU的影响
从图8中的胃形态可以看出,对照组大鼠的粘膜没有损伤。然而,与对照组大鼠进行比较,吲哚美辛处理大鼠的胃有严重的粘膜侵蚀、线条状和点状出血,意味着成功建立GU模型。相反,与模型组相比,用雷尼替丁或ARE预处理的动物显示出更少的胃损伤。
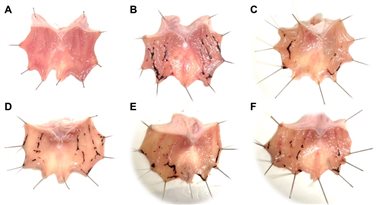
图8 胃形态学结果
(A)对照组。(B)模型组。(C)雷尼替丁组。(D)ARE 0.15 g/kg组。(E)ARE 0.3 g/kg组。(F)ARE 0.6 g/kg组。ARE,木香根乙醇提取物。
溃疡面积的定量分析与形态学观察结果一致(表5)。与模型组相比,雷尼替丁和ARE 0.6g/kg组的溃疡面积明显减少(p<0.05)。在ARE的三个剂量组中,ARE 0.6mg/kg组的溃疡面积最小,抑制率最高(50.26%,p<0.05)。
表5 ARE预防吲哚美辛诱导的GU作用
Group | Ulcer Area (mm2) | Inhibition Rate (%) |
Control | 0 | - |
Model | 45.0 ± 17.6 ## | - |
Ranitidine 40 mg/kg | 17.5 ± 4.8 * | 61.11 |
ARE 0.15 g/kg | 36.6 ± 3.8 | 18.61 |
ARE 0.3 g/kg | 30.8 ± 6.2 | 31.62 |
ARE 0.6 g/kg | 22.4 ± 4.3 * | 50.26 |
注:ARE,木香乙醇提取物;(##)表示与对照组相比的显著差异(p<0.01),(*)表示与模型组相比的显着差异(p<0.05)。
然后,使用H&E染色研究ARE对GU的保护作用(图9)。在对照组中,胃粘膜显示出正常的组织学表现。然而,吲哚美辛的给药引起了一系列胃病变,包括上皮细胞的丢失、炎症渗出和浸润以及血管充血。雷尼替丁和ARE(0.15、0.3、0.6 g/kg)预处理显示吲哚美辛诱导的病理恶化显著减轻。
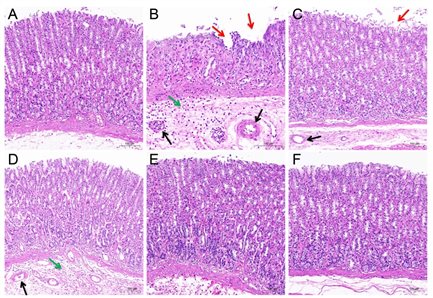
图9 胃H&E切片结果
(A)对照组。(B)模型组。(C)雷尼替丁组。(D)ARE 0.15 g/kg组。(E)ARE 0.3 g/kg组。(F)ARE 0.6 g/kg组。ARE,木香根乙醇提取物。红色箭头表示上皮细胞损失,绿色箭头表示炎症渗出和浸润,黑色箭头表示血管充血。
8. AR提取物减轻吲哚美辛诱导的炎症和氧化应激损伤
随后,检测胃组织中TNF-α、IL-1β、MPO和PGE2的水平。结果显示,与对照组相比,吲哚美辛增加了TNF-α(p<0.01)、IL-1β(p<0.01)和MPO的分泌,而减少了胃组织中PGE2的分泌。值得注意的是,雷尼替丁和ARE的预处理逆转了上述变化(图10)。
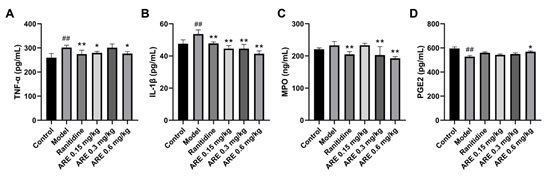
图10 ARE对胃组织中TNF-α、IL-1β、MPO和PGE2的影响。
(A)TNF-α。(B)IL-1β。(C)MPO。(D) PGE2。与对照组相比,##P<0.01;*与模型组相比P<0.05、**P<0.01。
讨论
AR是一种具有胃肠道保护作用的传统草药。本研究采用网络药理学和体内实验相结合的方法,探讨AR治疗GU的潜在物质基础、作用靶点和可能的分子机制,以解释AR成分的胃保护作用。因此,通过成分-靶点网络和PPI分析,预测了AR对抗GU的四种主要生物活性成分(stigmasterol、mairin、sitosterol和dehydrocostus lactone)和10个核心靶标(AKT1、PTGS2、IL1B、CASP3、CASP8、CYP2C19、NFKB1、MDM2、BCL2L1和ESR1)。分子对接模拟表明,预测的主要生物活性成分和核心靶点具有良好的结合亲和力。GO和KEGG的富集分析表明,AR对GU的保护作用涉及各种与GU愈合相关的生物过程和信号通路。同时,体内实验表明,AR的乙醇提取物减轻了吲哚美辛诱导的GU,这归因于对TNF-α、IL-1B、MPO和PGE2的调节作用。
药用植物对GU的治疗有显著作用,这取决于它们的多种化学成分。因此,揭示天然植物的化学成分尤为重要。目前,多种药用植物及其成分的抗溃疡作用及其机制已被揭示。例如,先前的报道记录了大蒜油提取物增强了PGE2的表达,从而保护消炎痛和牛磺胆酸钠引起的胃损伤,这种作用可能与大蒜中丰富的脂肪酸和类黄酮有关。然而,还需要进一步的探索来澄清哪种成分最有效。网络药理学方法为预测和揭示药用植物的有效成分提供了便利。本研究预测的主要生物活性成分的抗溃疡潜力或胃保护作用已在先前的研究中报道。sitosterol和stigmasterol对胃十二指肠粘膜具有保护作用。例如,Zhao等人的研究表明,stigmasterol可以通过抑制Akt/mTOR通路来诱导癌症细胞凋亡和保护自噬[37]。Onwuchekwa等人报道,使用1.5和3.0 mg/kg的mairin可以抑制吲哚美辛诱导的GU,还可以显著促进胃粘液的分泌。dehydrocostus lactone可以缓解乙醇诱导的小鼠GU,这被认为与TNF-α、COX-2和MDA的减少以及IL-10和PCNA的增加有关。因此,网络药理学预测的核心成分和靶点是有说服力的。
胃作为消化系统的重要组成部分,有许多特殊的微生物群落结构。胃肠道菌群,尤其是幽门螺杆菌,在GU的发病机制中发挥着至关重要的作用。目前,已经从AR中筛出出许多关键的抗菌成分。例如,costuslactone和dehydrocostus lactone可以抑制幽门螺杆菌和变形链球菌,sitosterol可以降低鼠伤寒沙门氏菌在细胞中的存活率。另一项研究发现,dehydrocostus lactone可以通过调节MAPK/NF-kB和AMPK/Nrf2途径,促进M2巨噬细胞的极化,减少M1的极化,从而减少革兰氏阳性菌引起的炎症反应。我们的GO富集分析结果还表明,AR对GU的作用涉及对脂多糖的反应、对细菌来源分子的反应和对细菌的反应,表明AR可以减少幽门螺杆菌和其他细菌对胃黏膜的有害因素损伤。此外,根据KEGG通路富集结果,人类巨细胞病毒感染通路与AR的抗溃疡作用有关,研究表明巨细胞病毒感染可引起GU,表明AR可用于治疗巨细胞病毒引起的GU。
当胃被幽门螺杆菌感染、在乙醇或非甾体抗炎药的刺激下,中性粒细胞和单核细胞可能浸润胃黏膜,产生TNF-α、IL-6和IL-1β等炎症细胞因子,这些是导致胃黏膜损伤的重要因素。IL-1β是一种关键的促炎细胞因子,对几乎所有组织的细胞防御和组织修复都至关重要。IL-1β具有许多生物学功能,与疼痛、炎症和自身免疫密切相关,并参与神经保护、组织重塑和修复,以及IL-6和TNF-α的调节等。我们发现IL-1β是AR对抗GU的核心靶点之一,并且与dehydrocostus lactone具有良好的结合能力(表4)。现有研究表明,所选成分可以通过下调IL-1β的表达来减少疾病的损害,这证实了其强大的抗炎活性。例如,cynaropicrin通过下调IL-1β来抑制脓毒症大鼠急性肾损伤引起的肾组织损伤;costuslactone和 dehydrocostus lactone显著降低了脂多糖(LPS)刺激的RAW264.7细胞中IL-1β的mRNA水平。此外,我们的GO和KEGG富集结果显示,AR和GU的共同靶点在炎症反应、TNF、NF-kB和IL-17信号通路中显著富集。研究表明,这些生物功能和途径可以调节促炎因子来缓解GU。我们的研究结果支持了这一推测。根据动物实验,ARE恢复了吲哚美辛引起的TNF-α和IL-1β含量升高(图10A-B),这证实AR通过具有抗炎作用来改善GU。
前列腺素(PG)是胃肠道中一种重要的粘膜防御和修复介质,其中PGE2是最有效的介质。环氧合酶(COX)是PG合成中的关键限速酶。COX有两种同工酶类型:COX-1和COX-2。COX-1由PTGS1基因编码,富含气体胃肠道,产生PG在胃肠道中发挥保护作用;COX-2由PTGS2基因编码,在胃中低水平表达,但它会被炎症刺激或损伤迅速诱导,这会促进炎症的逐渐扩大,也会抑制COX-1的表达,减少PG的合成,从而削弱胃黏膜防御功能。Zheng等人发现,在乙醇诱导的GU小鼠中,costuslactone可以抑制COX-2的表达,显示出胃保护作用。根据Bi等人的研究,β-sitosterol可以调节MAPKs和NF-κB信号通路,并降低TNF-α、COX-2和IL-6的表达。Liang等人报道,stigmasterol通过下调COX2和NF-κB的表达来减轻脑缺血/再灌注损伤。在我们的研究中,PTGS2是AR对抗GU的核心靶点之一,与AR的主要生物活性成分(stigmasterol和mairin)具有良好的结合亲和力。此外,PGE2具有四种特定亚型的G蛋白偶联受体(GPCR)EP1-EP4,它们与胃收缩、胃粘液分泌、血管生成、胃损伤愈合等密切相关。根据我们的GO富集结果,AR和GU的共同靶点在前列腺素受体活性的生物过程中显著富集,这涉及EP1-EP4(PTGER1-4)。根据Kim等人的研究,对胃泌素或胃酸分泌起抑制作用的PTGER2和PTGER3与癌症直接相关。Heinrichs等人证实胃组织中PTGER4表达上调是癌症发病的危险因素。此外,我们的体内实验还表明,在GU大鼠中PGE2水平下调,在ARE治疗组中上调,表明AR可能调节PGE2含量以抑制GU(图10D)。因此,从这些结果可以推断,AR可能通过调节COX2/PTGS2和PGE2来改善GU,甚至防止其发展为胃癌。
此外,胃上皮细胞增殖和凋亡之间的平衡对胃黏膜的完整性至关重要。当各种致病因素破坏这种平衡时,就会发生GU。研究表明,AR的主要活性成分可以促进细胞凋亡。Cheng等人发现,mairin和oleanolic acid的衍生物通过ROS介导的caspase-3信号通路的激活触发了三种人类癌症细胞系的凋亡。Oh等人表明,dehydrocostus lactone可通过增强caspase-3和caspase-8诱导人白血病HL-60细胞凋亡。stigmasterol通过抑制Akt/mTOR信号通路、诱导凋亡和保护性自噬来抑制癌症细胞的增殖。另据报道,Stigmasterol可通过降低Bax和CASP3的表达以及增加Bcl-Xl的表达来抑制细胞凋亡反应。此外,cynaropicrin抑制胃癌AGS细胞的G2/M周期并诱导细胞凋亡。根据PPI分析,AKT1、CASP3、CASP8、BCL2L1、MDM2和NFKB1与细胞周期阻滞和凋亡的调节密切相关。我们的KEGG富集结果表明,AR和GU的共同靶点在凋亡途径中显著富集。
综上所述,本研究通过网络药理学分析了AR治疗GU的潜在活性成分和机制,揭示了AR的多组分、多靶点、多途径抗溃疡模式;体内实验还表明,AR提取物可以预防吲哚美辛诱导的GU,其机制与TNF-α、IL-1B和PGE2的调节有关。这些发现为未来研究AR对抗GU的机制提供了重要证据,也为AR的进一步开发和利用提供了实验依据。然而,由于网络药理学中使用的数据库的准确性、完整性和可靠性,本研究中获得的潜在活性成分和核心靶点可能不同或缺失。因此,在未来的实验中,我们仍需通过大量临床试验和体内实验进一步证实这些活性成分对抗GU的机制。
结论
综上所述,AR通过多组分、多靶点、多机制的方式治疗GU:stigmasterol、mairin、sitosterol、dehydrocostus lactone等活性成分可能通过AKT1、PTGS2、IL1B、CASP3、CASP8等靶点发挥抗溃疡作用,主要与抑制细菌和病毒、抗炎活性、,PGE2的调节,细胞增殖和凋亡的调节以及其他途径。同时,AR可通过降低胃组织中的TNF-α、IL-1β和MPO,增加PGE2,从而预防吲哚美辛对胃黏膜的损伤,促进溃疡愈合。AR可能是一种有效的多靶点抗GU的草药。
原文连接:
https://www.mdpi.com/1648-9144/59/4/666
上一篇:无
下一篇:学术论文